Diferencias entre un Ensayo de PCR de tiempo real y uno de Punto Final
Con más frecuencia de lo común, la tecnología analítica de PCR y sus opciones para la expresión de los resultados, genera confusiones entre los usuarios y empresas o compañías interesadas en su implementación.
Los 3 tipos más comunes para la expresión de los resultados de un ensayo de PCR (Reacción en Cadena de la Polimerasa) son los siguientes:
* Electroforesis en gel
* Análisis de Curvas de Fusión en el PCR de Punto de Final
* Graficas de Fluorescencia de Tiempo Real en la técnica que le dá la misma denominación al PCR
Veamos brevemente cada una:
Electroforesis en gel:
- Separa a los fragmentos de ADN por su tamaño
- Las muestras de ADN se cargan en ranuras en un extremo del gel y se les aplica una corriente eléctrica para arrastrarlas a través del gel.
- Cuando un gel se tiñe con un pigmento que se une al ADN, los fragmentos de éste pueden verse como bandas, que representan fracciones de ese ADN del mismo tamaño.
Ver la imagen adjunta

Análisis de Curvas de Fusión en el PCR de Punto Final:
- Incorpora con mucha frecuencia un marcador fluorescente conocido como SYBR GREEN que no es muy específico y puede unirse a fragmentos de ADN no buscados/deseados.
- No puede detectar ni cuantificar en tiempo real la secuencia blanco
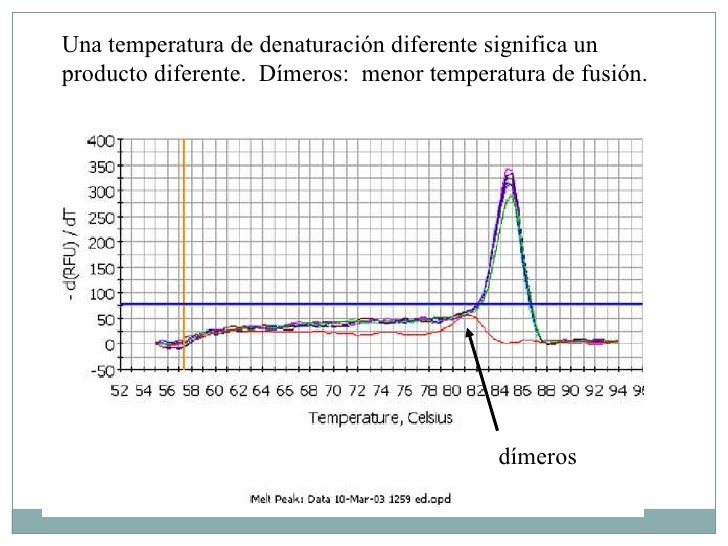
- Se realiza al final de la reacción un paso extra realizando una curva extra ó curva de fusión (melting curve) que evalúa si se formó un producto único (característico del ADN buscado como el un patógeno como Salmonella, Listeria, E.coliO157:H7, etc) ó si hay presencia de dímeros de primers, que traducido en mundo real, son segmentos amplificados no deseados que conducirían a un resultado falso positivo ó que el algoritmo del software que analiza estos patrones no sepa intepretarlo ( y se produce algo llamado "Indeterminado").
- Esta curva demora entre 45 y 70 minutos en la mayoría de los termocicladores, es decir, le añade una hora al proceso analítico de interpretación de resultados.
Gráfica de una curva de fusión:
PCR en Tiempo Real:
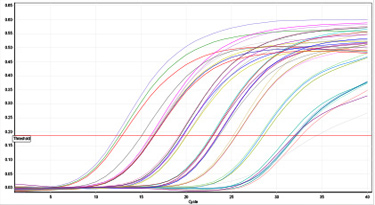
- Dentro de la mezcla se incorpora una sonda altamente específicas con un fluoróforo (hay al menos 6 tipos diferentes conocidos) que marca los fragmentos de ADN que está siendo amplificado. Esto ocurre en tiempo real de manera que si existe dicha amplificación será detectada con la formación de una curva característica que para dictaminar si es positivo, debe alcanzar un umbral o "threshold" mínimo
- Las sondas más comunes usadas tanto comercialmente como a nivel de investigación son las sondas TaqMan.
Entonces y en resumen para aclarar las diferencias, considerándolo como una persona que está buscando decidir entre un PCR de punto final y uno de Tiempo Real:
1) Los ensayos de Punto Final son más económicos que los de Tiempo Real.
2) Los ensayos de Punto Final son más tardados que los de Tiempo Real.
3) La especificidad del Tiempo Real es superior a del ensayo de Punto Final.
4) Existe una alta probabilidad de que en los ensayos de Punto Final existan resultados indeterminados tras el análisis de las curvas de fusión en comparación a los de Tiempo Real que suelen tener resultados directos positivos o negativos ó en su defecto, que la reacción no ocurriese y existan no amplificaciones.
Por el momento, hacemos una pausa y abordaremos otro tema en una próxima entrada.
Si desea saber más al respecto, comparto cuatro interesantes vínculos con datos bibliográficos en línea:
https://es.khanacademy.org/science/biology/biotech-dna-technology/dna-sequencing-pcr-electrophoresis/a/gel-electrophoresis
http://www.unizar.es/lagenbio/docencia/doctorado/fundamentosPCR.pdf
http://www.medigraphic.com/pdfs/invdis/ir-2013/ir132d.pdf
Si desea saber más al respecto, comparto cuatro interesantes vínculos con datos bibliográficos en línea:
https://es.khanacademy.org/science/biology/biotech-dna-technology/dna-sequencing-pcr-electrophoresis/a/gel-electrophoresis
http://www.unizar.es/lagenbio/docencia/doctorado/fundamentosPCR.pdf
http://www.medigraphic.com/pdfs/invdis/ir-2013/ir132d.pdf






